O que é Elemento Químico?
Denomina-se elemento químico um conjunto de átomos que têm o mesmo número de prótons em seu núcleo, ou seja, o mesmo número atômico (Z).
O termo elemento químico pode se referir também a elementos fundamentais da matéria, que não podem decompor-se em substâncias mais simples por métodos químicos, ou seja, elementos indivisíveis.
Este último conceito algumas vezes é chamado de substância elementar, diferindo da primeira definição, mas muitas vezes, o mesmo conceito é usado em ambos os casos.
Representação

Tabela Periódica

Representação na Tabela Periódica

O átomo é partícula fundamental da matéria. O nome átomo foi dado pelo filósofo grego Demócrito. Ele acreditava que todos os materiais possuiriam uma menor parte, que seria indivisível (a = prefixo Grego que significa falta de ; tomo = partes).
Daí surgia o nome Átomo, que no conhecimento daquela época seria a menor partícula existente que poderia ser dividida.
Os átomos porém são compostos de partículas menores: os prótons, os
nêutrons e os elétrons. No átomo, os elétrons gira ao redor do núcleo, que
contém prótons e nêutrons. O termo elemento químico pode se referir também a elementos fundamentais da matéria, que não podem decompor-se em substâncias mais simples por métodos químicos, ou seja, elementos indivisíveis.
Este último conceito algumas vezes é chamado de substância elementar, diferindo da primeira definição, mas muitas vezes, o mesmo conceito é usado em ambos os casos.
Exemplo:
Oxigênio é o elemento químico constituído por todos os átomos que possuem número atômico 8, isto é, com oito prótons.
Cálcio é o elemento químico constituído por todos os átomos que possuem número atômico 20, isto é, com vinte prótons.
Oxigênio é o elemento químico constituído por todos os átomos que possuem número atômico 8, isto é, com oito prótons.
Cálcio é o elemento químico constituído por todos os átomos que possuem número atômico 20, isto é, com vinte prótons.
Representação

Tabela Periódica

Representação na Tabela Periódica

O que é Átomo?
O átomo é partícula fundamental da matéria. O nome átomo foi dado pelo filósofo grego Demócrito. Ele acreditava que todos os materiais possuiriam uma menor parte, que seria indivisível (a = prefixo Grego que significa falta de ; tomo = partes).
Daí surgia o nome Átomo, que no conhecimento daquela época seria a menor partícula existente que poderia ser dividida.
Elétrons são minúsculas partículas que vagueiam aleatoriamente ao redor do núcleo central do átomo, sua massa é cerca de 1840 vezes menor que a do Núcleo. Prótons e nêutrons são as partículas localizadas no interior do núcleo, elas contém a maior parte da massa do átomo.
O Interior do Átomo
No centro de um átomo está o seu núcleo, que apesar de pequeno, contém quase toda a massa do átomo. Os prótons e os nêutrons são as partículas nele encontradas, cada um com uma massa atômica unitária.
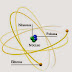
Como você pode perceber, o átomo é muito parecido com o Sistema Solar. No Sistema Solar, o sol fica no centro e ao redor dele giram os planetas. No átomo, de um modo semelhante, os elétrons giram em torno do núcleo, em órbitas dispostas em planos diferentes.
Num átomo, o número de prótons (p) é igual ao de elétrons. Mas o número de nêutrons pode ser diferente do de elétrons e de prótons.
Características das Partículas:
Prótons: tem carga elétrica positiva e uma massa unitária.
Nêutrons: não tem carga elétrica mas tem massa unitária.
Elétrons: tem carga elétrica negativa e quase não possuem massa.
Número Atômico (Z)
Os diferentes tipos de átomos (elementos químicos) são identificados pela quantidade de prótons (P) que possui. Esta quantidade de prótons recebe o nome de número atômico e é representado pela letra Z.
O número atômico identifica o átomo que estamos trabalhando.
Se um átomo tem número de atômico 6, é o carbono, apresenta 6 prótons.
Se um um átomo tem número atômico 13, é o aluminio, apresenta 13 prótons.
Z - Número Atômico
P - Prótons
Z = P
Verifica-se que em um átomo o n.º de prótons é igual ao n.º de elétrons (e), isto faz com que esta partícula seja um sistema eletricamente neutro.
P = e
Resumindo:
O número atômico é igual a quantidade de prótons que é igual a quantidade de eletróns, sendo ele um sistema eletricamente neutro.
Z = P Z = P = e
O número atômico é igual a quantidade de prótons que é igual a quantidade de eletróns, sendo ele um sistema eletricamente neutro.
Z = P Z = P = e
Número de Massa (A)
Outra grandeza muito importante nos átomos é o seu número de massa (A), que corresponde à soma do número de prótons (Z ou P) com o n.º de nêutrons (N).
A = P + N
Exemplos:
Vamos calcular o elemento químico Sódio-23 (Na), como mostrado na figura abaixo.

O sódio é um elemento químico de símbolo Na (Natrium em latim), de número atômico 11 (11 eletróns, 11 prótons e 12 nêutrons) e massa atômica 23 u (Unidade Atômica).
Temos os dados:
Número atômico → Z =11
Número de prótons → P = Z = 11
Número de elétrons → P = Z = e = 11
Número de Neutrons → n = A - Z
Número de massa → A = Z + n
A = 11 +12
A = 23
Outras Definições:
Átomo neutro
Aquele em que o número de prótons é igual ao número de elétrons.Exemplo:
11Na23 e 8O16
Íon
Espécie química cujo número de prótons é diferente do número de elétrons. Os cátions são formados por retiradas de um ou mais elétrons da eletrosfera de um átomo: íon carregado positivamente.Exemplos:
2311Na1+ = perdeu 1 elétron
3517Cl1- = ganhou 1 elétron
Ânions
São formados quando adicionamos um ou mais elétrons à eletrosfera de um átomo: íon carregado negativamente.Exemplos:
168O2- = ganhou 2 elétrons
3517Cl1- = ganhou 1 elétron
Isótopos: É quando os átomos comparados possuem mesmo n.º atômico (lembrando que Z=P) e diferente número de massa.

A diferença nos pesos atómicos resulta de diferenças no número de neutrons nos núcleos atómicos, ou seja, os isótopos são átomos que possuem a mesma quantidade de prótons, mas não a mesma de neutrons.
Ex.: O átomo de Hidrogênio possui três formas de isótopos: o Prótio (1 próton sem nêutron) o Deutério (1 próton e 1 nêutron) e o Trítio (1 próton e 2 nêutrons).
Na nomenclatura científica, os isótopos são designados pelo nome do elemento seguido por um hífen e pelo número de núcleons (prótons e nêutrons) no núcleo atómico (ex: ferro-57, urânio-238, hélio-3). Na forma simbólica, o número de núcleons é escrito como um prefixo subido do símbolo químico (ex: 57Fe, 238U, ³He).
Isóbaros: São átomos que possuem mesmo n.º de massa e diferentes números atômico.

Ex.:
6C14 (A=14 e Z=6) e 7N14 (A=14 e Z=7)
Diz-se que os elementos C e N são isóbaros quando comparados.
Isótonos: São átomos que possuem mesmo n° de nêutrons e diferentes números atômicos e de Massa.

Espécie Isoeletrônicas
São as espécies químicas que possuem a mesma quantidade de elétrons.
O átomo N e o íon radical O+ são isoeletrônicos porque cada um tem 5 elétrons na camada eletrônica exterior.
Da mesma forma, os cátions K+, Ca2+, e Sc3+, os ânions Cl−, S2−, e P3− são todos isoeletrônicos com o átomo Ar.
Em tais casos monoatômicos, há uma tendência clara nos tamanhos dessas espécies, com raio atômico diminuindo à medida que a carga aumenta.
CO, N2 e NO+ são isoeletrônicos porque cada um tem 2 núcleos e 10 elétrons de valência - 4+6, 5+5, e 5+5, respectivamente. Talvez seja mais preciso pensar na molécula de dióxido de carbono, como C-O+, considerando a sua coordenação, o que lhe confere uma distribuição 5+5 de elétrons como os outros.
Para se lembrar dos nomes, tente pensar da seguinte forma:
• Ao ler isótoPos, lembre-se do P, de próton.
• Ao ler isótoNos, lembre-se do N, de nêutron.
• Ao ler isóbAro, lembre-se do A, de massa.
Exercício Resolvido
1. Dados os elementos X, Y e Z:
• X e Z são isótopos (Possuem o mesmo número atômico (Prótons = 16);
• Y e Z são isóbaros (Possuem a mesma quantidade de massa = 32);
• Z tem massa 32;
• Z possui 16 elétrons;
• X tem 2 Nêutrons a mais que Z;
• X e Y são isótonos
Dê os números de massa, prótons e nêutrons de cada elemento.












0 Reviews:
Post Your Review